M T. Herrero
Departamento de Ciencias Morfológicas y Psicobiología
Facultad de Medicina. Univ. de Murcia.
"Es imperativo que los clínicos y los científicos comiencen a apreciar la complejidad de la orientación sexual y se resistan a buscar explicaciones simplistas ya sean psicológicas o biológicas"
(Byne y Parsons, '93)
Diferenciación Sexual
¿Como es posible que con un material genético idéntico en el que solo se diferencian los cromosomas sexuales existan diferencias tan evidentes entre hombres y mujeres? Las diferencias comienzan en etapa temprana del desarrollo embrionario (ver Figura 1). Estas diferencias son reflejo del dimorfismo genético que condiciona cambios hormonales (Naftolin, '81). Las hormonas van a actuar sobre el organismo (cerebro y órganos sexuales) en desarrollo. En etapas tempranas de la vida, la acción de estrógenos y andrógenos establecen las diferencias físicas de los sexos. La incidencia de estos factores sobre el organismo hace que un feto genéticamente XY (o XX con el gen SRY, Sinclair y cols., '93) comience a desarrollar los rasgos masculinos como la aparición de testículos, escroto y pene. A su vez los testículos son capaces de sintetizar la testosterona que 'masculiniza' al feto. La acción de las hormonas puede modificar las estructuras cerebrales responsables del dimorfismo sexual. Estas modificaciones tienen lugar del tercer-cuarto mes intrauterino hasta los primeros meses/años tras el nacimiento.
Son múltiples los estudios que han comparado variaciones cognitivas y habilidades motoras en relación a variaciones anatómicas del cerebro y su funcionalidad dando gran importancia a los acontecimientos biológicos que pueden influir en el proceso de desarrollo del cerebro (Witelson, '91a,b). La influencia de las hormonas sexuales (especialmente los niveles de testosterona) en el periodo prenatal es asumida como diferenciadora de la organización cerebral y la conducta, y parece incluso contribuir a la variabilidad individual (Arnold y Gorski, '84; DeVoogd, '87). La identidad de los centros nerviosos está determinada por dos procesos complementarios: la especialización precoz debida a factores genéticos (o intrínsecos) y la influencia epigenética o ambiental (Kennedy y Dehay, '94). Según la teoría de la diferenciación sexual del cerebro (Dorner, '85) existen evidencias fisiológicas que indican la diferenciación masculina, femenina o andrógino en adultos y adolescentes, pero esta teoría no es aceptada por todos los investigadores (Swaab y cals., '92).
En relación al dimorfismo sexual del cerebro y sus implicaciones en la orientación sexual, y aunque ningún resultado es absolutamente concluyente, se han estudiado variaciones en el tamaño de diferentes núcleos cerebrales, lateralización cerebral, preferencia de utilización de una u otra mano, niveles de testosterona, características de personalidad y habilidades motoras y/o cognitivas.
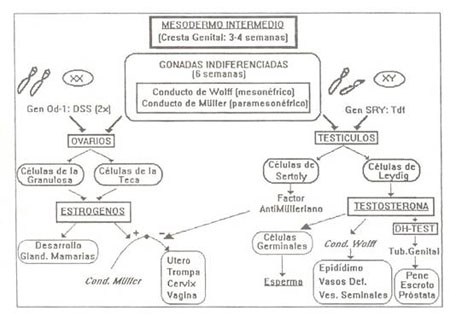
Figura 1: Desarrollo Intrauterino
El desarrollo embrionario comienza con un oocito fertilizado que contiene un par de cromosomas sexuales, XX si se trata de una mujer o XY si se trata de un varón. Con los conocimientos actuales, se cree que el sexo del embrión no establece diferencias en las primeras semanas del desarrollo y a nivel del mesodermo intermedio se puede observar la cresta genital indiferenciado (3-4 semanas). A partir de la sexta semana, se evidencia en el embrión el rudimento de los sistemas reproductores, el conducto de Wolff (o conducto mesonéfrico) que dará origen al sistema reproductor masculino, y los conductos de Muller (o conductos paramesonéfricos) que se convertirán en el sistema reproductor femenino. El cromosoma Y es responsable de la formación de los testículos (gónadas masculinas) que van a producir las hormonas para la conversión en macho. En la región 1 del brazo corto del cromosoma Y se localizan los genes responsables de la formación de las gónadas masculinas (sex-cletermining region of the Y chromosome, SRY, de 14 kilobases, y testes determining factor,Tdf) (Sinclair y cols.,93; Koopman y cols., 191; Hawkins, 193). La síntesis de la hormona masculinizante, testosterona, en las células gonodales de Leydig promueve el desarrollo de los genitales externos: 1) las células germinales podrán producir esperma, 2) el primitivo conducto de Wolf se transforma en epidídimo, vasos deferentes y vesículas semanales y 3) el tubérculo genital influido por el metabolito de la testosterona (dihidrotestosterona) se modifica en pene, el área glandular se desarrolla dentro de este, y las turgencias labiosacrales originan el escroto. Los testículos en formación comienzan el descenso, migración hacia el exterior (donde la temperatura,<37’C, permitirá la maduración del esperma). Las células de Sertoly de los testículos producirán el factor anti-Mulleriano que inhibe el desarrollo del Conducto de Muller que entra así en regresión. Si ocurre alguna anomalía en este proceso, el individuo queda incompleto en su masculinización fenotípica. Tanto la diferenciación masculina como la femenina son procesos activos genéticamente regulados. No significa que la diferenciación femenina sea diferenciación por defecto. El gen Od-1(DSS) localizado en el brazo corto del cromosoma X (Xp21) (Bardoni y cols.,’94) favorecería el desarrollo del ovario (gónada femenina) e inhibiría el desarrollo de los testículos. La presencia de dos genes DSS (dos cromosomas X, región Xp21-Xp22.3) haría diferenciarse el aparato genital femenino (Parkhurst y Meneeley,’94) cuando solo existe un gen DSS y un gen SRY (cromosomas XY) el embrión se diferencia como masculino. Si el embrión es “femenino” (XX), las góndolas se transforman en ovarios y permanecen en el lugar de origen, sin migración. Tanto las células de la Teca como las Células de la Granulosa segregan estrógenos que van a desarrollar: 1) las glándulas mamarias, 2) el útero, la trompa, el cerviz y la vagina partir del conducto Meller y 3) el área glandular se convierte en clítoris y las turgencias labiosecrales en labios mayores localizados rodeando el orificio vaginal.
Tanto el embrión es masculino como femenino, no esta influenciado por las hormonas femeninas de la madre, estrógenos, que no son capaces de atravesar la barrera placentaria por estar ligados a la a-feto-proteina, Sin embargo, si un embrión genéticamente mujer (XX) queda expuesto a la acción de la testosterona en el momento del desarrollo, se diferenciará anónimamente y probablemente su esterilidad hará patente la anomalía. De igual modo, en embrión genéticamente varón (XX) cuyos tejidos sean insensibles a la acción de los andrógenos, se diferenciará físicamente como mujer aunque posea testículos. La insensibilidad a la acción de los andrógenos provocará la esterilidad.
Orientación Sexual
La mayoría de los hombres y mujeres sienten atracción sexual por personas del sexo opuesto, pero del 1 a 5% de la población solo sienten atracción por personas de su mismo sexo, y otros en grado variable indistintamente por ambos. La orientación sexual es un concepto peculiar del ser humano. Solo en la especie humana encontramos individuos que presentan preferencia homosexual exclusiva. ¿Es que la orientación sexual tiene una explicación biológica? Aunque muchos investigadores han hipotetizado la existencia de un factor biológico de la homosexualidad, y a pesar que las nuevas tecnologías son incorporadas como vías de responder a esta pregunta, todavía falta evidencia empírica absoluta (Byne y Parsons, '93; Bancroft, '94; Swaab y Hofman, '95). La escasa consistencia de los datos se debe a que hay múltiples factores ambientales imposibles de evaluar. La influencia tan dispar de las hormonas en la conducta indica la flexibilidad y variabilidad del ser humano cuya experiencia personal es crucial (Friedman y Downey, '93). Los indicios obtenidos hasta el momento actual son fragmentarios indicando que la orientación sexual es consecuencia de un proceso de desarrollo multifactorial en el cual toman parte tanto los factores biológicos como los factores psicosociales.
En experimentación animal es claro que la diferenciación sexual no queda completa con la formación de los genitales (Figura 1) sino que existe también una diferenciación sexual en cerebro femenino (mujer) o masculino (varón) (Figura 2A, 2B). El cerebro (como los genitales externos) es susceptible de variaciones por acción de las hormonas, masculino en presencia de andrógenos y femenino en ausencia de andrógenos. En este sentido, se ha propuesto que el cerebro de individuos homosexuales sería conceptualmente una forma de pseudohermafroditismo ya que se desarrollarían “cerebros femeninos” en cuerpos masculinos y viceversa (Corner, 185). Aunque este hecho se demuestra en animales inferiores (Ehrhardt y Meyer- Bahlburg,’81), en primates no se ha determinado el papel de las hormonas como determinante de la identidad sexual del individuo (Karsch y cols., ´73; Norman y Spies,’86 ). La orientación sexual emerge de la interacción entre el ambiente y las características de personalidad dentro de fenómenos del más alto nivel psicológico (Figura 2). La orientación sexual no es dimórfica sino polimórfica: las motivaciones conscientes o inconscientes asociadas con la atracción sexual humana divergen incluso entre las personas del mismo sexo e inclinación sexual. La comprensión del sexo de la persona comienza por su identificación en el sexo biológicogenético (genotipo que determina la dicotomía sexual: XX o XY, figura 2A). Si bien esta determinación biológica implica generalmente la formación secreción de hormonas masculinas o femeninas (sexo endocrino) responsables de la caracterización fenotípica (mujer-varón), está solidamente demostrado que el ambiente socio-cultural imprime su influencia (Figura 2B).
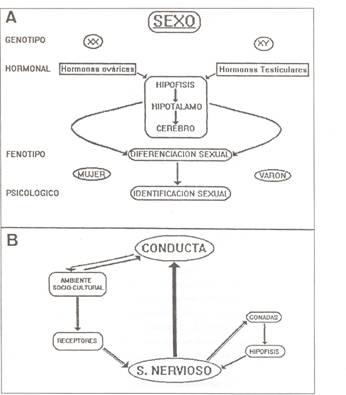
Figura 2
- Diferenciación e identificación sexual: sexo genético, sexo hormonal, sexo fenotípico y sexo psicológico
-
Interacción del ambiente socio-cultural en la conducta de los individuos a través de su interacción con el sistema nervioso central
El sistema nervioso es un órgano plástico durante toda la existencia vital, cuya mayor actividad plástica se concentra en la vida prenatl. Los factores físico-químicos y la experiencia pueden alterar las estructuras cerebrales y su fisiología (Figura 2B) y la determinación biológica queda limitada como término ambiguo. Si la orientación sexual, al igual que otros aspectos de la personalidad, está expresada en el cerebro, nos preguntamos, ¿cómo, dónde, cuando?. Estará determinada por factores hormonales, genéticos, físicos o químicos (antes, durante y después del nacimiento), por la experiencia y por el ambiente social y cultural. Pero, ¿existe una predisposición que al variar las circunstancias de cada individuo haga que se demuestre una orientación sexual concreta o esta ya determinada?.
Se ha entendido:1) que la orientación homosexual es una desviación de la norma, 2) que su aceptación está sujeta a las tradiciones culturales y 3) que se deriva de un defecto biológico o de socialización (Byne y Parson, ‘93). La mayoría de los estudios sobre homosexualidad establecen: 1)que la heterosexualidad es la norma y que no requiere una explicación científica, y 2) que la homosexualidad es una forma de intersexualidad que no alcanza la diferenciación sexual quedando situada biológicamente entre el hombre heterosexual normal y la mujer heterosexual normal (Bancroft, '94).
Las hipótesis en relación al origen biológico de la homosexualidad son: 1) existencia de un rasgo estructural (del sistema nervioso) reconocible que indique la existencia de circuitos neuronales específicos en individuos homosexuales y 2) existencia de determinación genética. Ambas establecerían la conducta homosexual como manifestación "obligatoria" en determinados individuos independientemente de su contexto biográfico (Barinaga, '91; Maddox, '91). El proceso real de diferenciación sexual debe ser un modelo interactivo en el que los genes y/o las hormonas no especifican la orientación sexual per se, pero definen la manera en que un individuo relacionándose con su entorno va a matizar su orientación sexual y otras características de su personalidad. El doble control genético y ambiental del desarrollo del sistema nervioso (corteza cerebral) proporcionan el marco conceptual para comprender la maduración de las facultades cognitivas y emocionales del ser humano (Kennedy y Dehay, '94). Existe un papel activo del individuo en construir su propia identidad.
Podemos estudiar cuatro aspectos de la investigación biológica sobre la homosexualidad que determinaran sus bases neurobiológicas: A) los factores hormonales, B) las estructuras cerebrales, C) la función neuropsicológica (en estrecha relación con variaciones estructurales-funcionales del sistema nervioso), y D) los factores genéticos.
A. FACTORES HORMONALES
Podríamos imaginar que los andrógenos son producidos Únicamente por los machos y los estrógenos por las hembras, pero tanto los testículos como los ovarios producen ambas hormonas. Los andrógenos forman parte de la vía en la síntesis de estrógenos. La diferencia entre machos y hembras es cuantitativa y no cualitativa: los machos producen mucha testosterona y muy poca se utiliza en sintetizar estradiol y las hembras producen poca testosterona y sintetizan más estrógenos. El papel de las hormonas sexuales no se limita a desarrollar los aspectos primarios y secundarios externos del fenotipo masculino o femenino, sino que existen receptores de estas hormonas en prácticamente todos los tejidos del organismo, incluido el cerebro (Breedlove, '83) que es rico en aromatasas y 5a-reductasa (que convierte la testosterona a dihidrotestosterona).
Las bases para la teoría hormonal incluyen los efectos de activación de las hormonas sexuales durante la adolescencia y, quizá mas importante, su impacto en el cerebro en desarrollo durante la vida prenatal (Anderson y cols., '86; Burek y cols., '95).
Hipótesis hormonal prenatal
La teoría predominante en la orientación sexual es que esta se desarrolla como resultado de la interacción de las hormonas sexuales con el cerebro en desarrollo. En este sentido y desde los estudios de Dorner y cols. (1975), el cerebro de homosexuales varones estaría diferenciado como el de las mujeres. Esta teoría ha sido apoyada por diversos estudios (Ehrhardt y cols., '85; Ehrhardt y Meyer-Bahlburg, '81; Dorner, '88; Dorner y cols., '91; Gladue y cols., '84) basados en el patrón de secreción de la hormona luteinizante (LH) y la depresión de los niveles de testosterona en varones homosexuales, y varones y mujeres heterosexuales tras la estimulación con estrógenos. El utilizar estas variables como marcadores biológicos de la orientación sexual ha sido, no obstante, discutido (Baum y cols., '85).
En general, la secreción hormonal está determinada en el genotipo del individuo, bien sea XX o XY (Figuras 1 y 2A). Durante las décadas 40 a 70 se creía que los individuos homosexuales eran diferentes porque habían perdido (o no habían adquirido) el comportamiento normal de los varones heterosexuales al carecer de las hormonas sexuales masculinas (Meyer-Bahlburg, '77). Las hormonas serían las responsables de imprimir su diferenciación biológica en las regiones (cerebrales o no) del dimorfismo sexual. Estos hallazgos afianzaron la teoría hormonal del origen de la homosexualidad. Niveles altos de andrógenos en la época perinatal producirían heterosexualidad en varones y homosexualidad en mujeres (Rochellys-Diaz y cols., '95). A la inversa, bajos niveles de testosterona perinatal producirían heterosexualidad en mujeres y homosexualidad en varones. Así, en los mamíferos inferiores se sabe que la diferenciación sexual resulta del efecto de la "masculinización" que tiene lugar durante el desarrollo en el periodo fetal intrauterino (a partir del cuarto mes de gestación y hasta los dos-cuatro años postnatales en humanos). La "desfeminización", que implica la supresión del comportamiento reproductivo femenino y la capacidad del hipotálamo para regular el ciclo ovárico en la rata, estaría relacionada con la aromatización de la testosterona (McEwen y cols., '77; Swaab y cols., '95). Sin embargo, la aromatización varía con las especies (Lubahn y cols., '93) y en el humano existen documentados casos de hombres y mujeres (genéticamente XY y XX respectivamente) con deficiencia de la aromatasa, que si bien mostraban variaciones fenotípicas, no presentaban variaciones en la orientación sexual respecto a su genotipo (Finkelstein y cols., '92; Itoh y cols., '93; Smith y cols., '94).
La teoría hormonal prenatal se basa en estudios realizados en roedores analizando la capacidad de lordosis de las hembras como atributo de "feminización" y la capacidad de cubrir de los machos como atributo de "masculinización" (Meyer-Bahlburh, '77). La lordosis es la postura que permite (normalmente a la hembra) ser cubierta por el macho favoreciendo la eyaculación. Este reflejo esta integrado en el núcleo ventromedial del hipotálamo que es sexualmente dimórfico en la rata (Parsons y cols., '81); su activación es paralela al aumento de síntesis de receptores de progesterona en este núcleo. La "masculinización" (normalmente en los machos) es medida como el comportamiento de exploración, agresividad y disposición a cubrir a las hembras. Esta conducta masculina exige la participación de los andrógenos. Puede ser activada al administrar andrógenos en la región preóptica del hipotálamo anterior de ratas castradas (Heimer y Larsson, '66). Amplias lesiones del área disminuyen discretamente esta conducta (De Jonge y cols., '89) y lesiones pequeñas no la modifican (Arendash y Gorski, '83). La secreción de andrógenos también desarrolla la "desfeminización" que se caracteriza por la ausencia de lordosis, ausencia del ciclo reproductivo femenino y ausencia del "feedback positivo" de respuesta del hipotálamo a la acción de los estrógenos. Todos estos estudios han sido realizados en roedores y estos paradigmas de estudio (lordosis o cubrimiento) carecen de validez para ser extrapolados al hombre, ya que pueden entenderse como estereotipos y es difícil imaginar que la plasticidad del comportamiento sexual humano pueda ser reducido a factores tan simples (Karsch y cols., '73; Byne y Parsons, '93). Desde el punto de vista anatómico, el cerebro de roedores (lisencéfalos) tanto en tamaño como en desarrollo filogenético (probablemente controlado genéticamente, Riska y Atchley, '85) dista mucho del cerebro de primates y en concreto del cerebro humano (Figura 3). Los estudios en humanos son discordantes y solo tres estudios demuestran que los varones homosexuales tengan niveles de testosterona más bajos que los heterosexuales, veinte estudios demuestran que no hay diferencias y dos estudios presentan niveles de testosterona más elevados (Meyer-Bahlburg, '84). Sin embargo, estudios en mujeres con hiperplasia adrenal congénita o expuestas al dietilestilboestrol durante su gestación han demostrado ciertas tendencias homosexuales (Dorner y cols., '91; Hines y Collaer, '93), y es conocido que los esteroides gonadales o externos pueden influenciar el desarrollo y fisiología del cerebro, incluyendo neurogénesis, sinaptogénesis, migración celular y muerte neuronal (Raisman y Field, '73). Pero, si la hipótesis hormonal prenatal fuera absolutamente correcta, cabría esperar que fuera homosexual el número enorme de varones con afecciones asociadas a una deficiencia androgénica prenatal y que lo fueran también las mujeres expuestas a un exceso de andrógenos antes del nacimiento. Ni una cosa ni la otra son ciertas (Byne, '94).
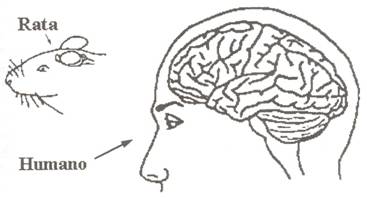
Figura 3
Comparación a escala del cerebro de rata (lisencéfalo) con el cerebro humano (de gran desarrollo cortinal: circunvoluciones)
Feedback hormonal
El interés del feedback hormonal se basa en estudios realizados primariamente en roedores (Barraclough y Haller, '70). Se establece que los estrógenos en el hipotálamo femenino ejercen un feedback negativo y positivo para la liberación de hormona luteinizante (LH). En ratas macho los estrógenos solo reproducen el feedback negativo y la administración de andrógenos prenatales (o la castración perinatal de ratas macho) impide el feedback positivo.
Basados en estos datos, se planteó la hipótesis de que los varones homosexuales tendrían deficiencia androgénica prenatal. Varios grupos (Dorner y cols., '75; Gladue y cols., '84) demostraron la evidencia de un efecto feedback positivo parcial en varones homosexuales que ha sido ampliamente discutido (Baum y cols., '85). En primates no existe el dimorfismo sexual en la secreción de LH (Karsch y cols., '73; Norman y Spies, '86). En un elegante estudio realizado en homosexuales, transexuales y sus respectivos controles, se determina que la respuesta a la administración de estrógenos es consecuencia del medio hormonal en el momento preciso y que el hipotálamo del hombre al igual que el de los primates no humanos no es sexualmente dimórfico en su respuesta de liberación de LH (Gooren y cols., '86a,b) . Si en el ser humano no existe dimorfismo sexual neurológico en este feedback hormonal, no se puede esperar que los individuos homosexuales presenten respuesta femenina, ya que ésta no existe como tal.
B. ESTRUCTURAS CEREBRALES
Desde hace tiempo los investigadores buscan en el cerebro humano (y de animales) algún tipo de manifestación que guarde relación con el sexo, pero el dimorfismo sexual no es fácil de establecer (Hofman y Swaab, '91; Swaab y Hofman, '95). Como explica Bancroft (1994), cuando se creía que la inteligencia estaba localizada en los lóbulos frontales, los hombres tenían más desarrollados éstos que las mujeres, que les superarían en el tamaño de lóbulos parietales. Cuando se creyó que la inteligencia estaría localizada en los lóbulos parietales, se invirtió el tamaño proporcional del cerebro de hombres y mujeres.
Figura 4
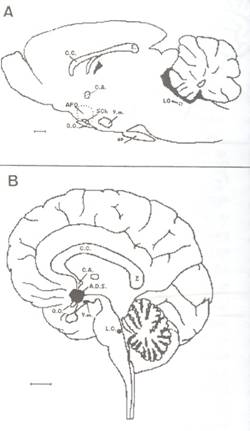
Vistas sagitales de cerebro de rata (A) y de cerebro humano (B), donde se pueden identificar las regiones sexualmente dimórficas. Abrev.: A.D.S. (área dimórfica sexual que comprende el área preóptica y los núcleos supraquiasmático, supraóptico y paraventricular del hipotálamo); APO (área preóptica); C.A. (comisura blanca anterior); C.C. (cuerpo calloso); E (esplenio); H.P. (hipófisis); L.C. (locus coeruleus); Q.O. (quiasma óptico); Sch. (núcleo supraquiasmático); V.m. (núcleo ventromedial del hipotálamo). Escala en A= 1mm. Escala en B=2 cm.
Núcleos cerebrales
Normalmente el varón tiene un cerebro de mayor tamaño (en consonancia con su cuerpo). Aunque, en el año 1973 Raisman y Field establecieron, por microscopía electrónica, diferencias sinápticas en el área preáptica (APO), solo en el año 1978, Gorski y cols. pudieron establecer morfológicamente que esta zona del hipotálamo anterior (Figura 4A), que estaba en relación con el comportamiento instintivo y la regulación del metabolismo, parecería ser significativamente mayor (ocho veces) en las ratas macho que en las hembras y la denominó núcleo sexual dimórfico del APO ("sexually dimorphic nucleus of the preoptic area", SDN-POA) . En primates no se ha demostrado este dimorfismo sexual en relación al tamaño celular sino respecto al volumen del núcleo (Hofman y Swaab, '89; Swabb y cols., '92; Swaab y Hofman, '95). El SDN-APO, cuyas neuronas poseen gran número de receptores para andrógenos y estrógenos (Greenstein, '78; Breedlove, '86), forma parte de la región que se extiende desde la "Lamina terminalis" hasta el núcleo de la estría terminal, que ha sido involucrada en el comportamiento sexual masculino (monos con lesión de esta área se muestran indiferentes a la interacción con hembras, y su estimulación hace que el macho se disponga a montar a la hembra)
El hipotálamo, denominado erróneamente por Brocal como ‘una parte banal de encéfalo’, constituye en su conjunto una pequeña porción del encéfalo (4 gramos frente a 1400 gr. del total) y comprende la mayor parte de los núcleos cerebrales sexualmente dimórficos. En 1985, Swaab y Fliers observaron como el núcleo anterior del hipotálamo (o núcleo intermedio) del cerebro humano (Braak y Braak, ’87) (Figuras 4B y 5), que correspondería al SDN-POA de Gorski y cols. (1978), era mayor en los hombre que en mujeres. En humanos, este núcleo ha sido denominado núcleo intersticial del hipotálamo anterior (INAH= intersticial nucleus of the anterior hypothalamus) por Allen y cols. (1989ª) y comprende 4 subnúcleos (INAHL, INAH2, INAH3 y INAH4) localizados entre el núcleo supraóptico y el núcleo paraventricular(Figura 5; Nota: INAH1 e INAH2 son más anteriores en el plano rostro- caudal INAHL) se identifica como el núcleo intermedio de Swaab y Fliers. Allen y cols (’89a) no hallaron dimorfismo sexual en INAH1 pero si lo encontraron en INAH2 y INAH3.El dimorfismo comienza en la pubertad (no antes de los cuatro años) (Swaab y Hofman, ’88, ’95) cuando las mujeres jóvenes pierden la mitad de las neuronas. Así mismo, existe perdida paulatina con la edad en ambos sexos (Jacobson y cols., ’80) siendo marcadamente elevada la perdida a los 50 años en los varones y a los 70 años en las mujeres (Swaab y Hofman, ’95). Estos cambios se creen están en relación con la actividad sexual y con los cambios de niveles hormonales pero existe gran controversia de datos según los diferentes grupos de investigadores.
Le Vay (1991) describió una importante diferencia en el núcleo INAH3 entre homosexuales y heterosexuales (varones ambos) en la que los segundos duplicaban el tamaño del volumen del núcleo. Sin embargo, el grupo de Swaab no encuentra diferencias en relación a la orientación sexual en ninguna de las divisiones del INAH (Hofman y Swaab,’91). El trabajo de Le Vay (1991) ha sido ampliamente comentado por su metodología e investigadores del mismo campo critican sus conclusiones. Sus resultados no han podido ser repetidos y corroborados por razones técnicas. Se le critica que: 1) utilizó técnicas morfométricas clásicas, y aunque apropiadas, excesivamente simples. La edad de los sujetos de estudio, el tiempo premortem y postmortem, y los métodos de fijación del tejido no fueron uniformes. Además, los cortes de hipotálamo teñidos con azul de toloudina (tinción poco afortunada para este tipo de estudio) tenían 52 pm de grosor (excesivamente gruesos para distinguir los cuerpos neuronales a 83 aumentos). Además, debido a que solo midió el contorno del núcleo (aunque aparentemente evidente, es un parámetro subjetivo) e ignoró la densidad neuronal (número de células por unidad de volumen) no puede aseverar ninguna funcionalidad a sus resultados. 2) El análisis estadístico utilizado, mas moderno que las técnicas histológicas, obtenía significación a pesar de presentar un grado de dispersión tan elevado dónde los valores de volumen del núcleo INAH3 se solapaban ampliamente entre el grupo homosexual y el grupo heterosexual (homosexuales0.00-0.19 mm3; heterosexuales =0.01-0.21mm3). El propio autor en la discusión no refleja si su resultado es la causa o consecuencia de la orientación sexual o si el tamaño varía en la relación a otras variables no identificadas. Sin embargo, en su libro The sexual brain (1993) realiza aseveraciones que superan los resultados obtenidos al establecer que los factores biológicos intervienen directamente en la determinación de la orientación sexual. Desde el punto de vista formal, Le Vay utilizó (a la excepción de 1 caso) cerebros de homosexuales fallecidos por infección del virus del SIDA. Es imposible deducir si la variación del tamaño del núcleo (probablemente debida a la caída de los niveles de testosterona) era relativa a su homosexualidad, al estadio terminal de la enfermedad o bien al tratamiento farmacológico seguido (Crosxon y cols.,’89).Cabría esperar que las variaciones que Le Vay encontraba no fueran debidas a la orientación sexual sino a trastornos hormonales asociados con el SIDA (Croxson y cols., ’89) ya que el tamaño de las neuronas de INAH3 varía con los niveles de testosterona (Commins y Yahr,’84) y se ha demostrado pérdida celular de neuronas con oxitocina en el núcleo paraventricular del hipotálamo en pacientes fallecidos con SIDA (Purba y cols., ’93)
Otros núcleos hipotalámicos probablemente implicados en el dimorfismo sexual son el núcleo supraquiasmático y el núcleo ventromedial (figuras 4A,B y 5):
El núcleo supraquiasmático (SQ, una pequeña estructura de 0.25 mm3, en humanos, Figura 5) coordina los ritmos circadianos y circaanuales (Zucker y cols.,’91; Hofman y Swaab,’94). Para ser bien reconocido morfológicamente en el tejido humano, ha de ser inmunoteñido con anticuerpos (v.g./vasopresina).El volumen del núcleo es sexualmente dimórfico, siendo mayor en los varones que en las hembras (Swaab y cols.,’85). El número de neuronas presentes en este núcleo decrece dramáticamente (50%) desde los dos primeros años de edad hasta la edad adulta (Swaab y Hofman’95), existiendo también una marcada relación con la estación del año y los periodos fotoactivos. En individuos homosexuales (varones) se ha demostrado que este núcleo es dos veces mayor cuando se compara al del grupo de individuos heterosexuales control (Swaab y Hofman, ’90). No se ha encontrado una explicación al significado funcional, ya que este núcleo no esta directamente relacionado con la orientación sexual en roedores (Kruijver y cols.,’93), ni aparentemente estaría relacionado con la secreción hormonal, aunque recientemente se ha observado relación conductual en la orientación sexual y la fase circadiana (Bakker y cols.,’93). En base a sus hallazgos en humanos y roedores, Swaab y cols., (1992) no aceptan la hipótesis de Ddbrner y cols., (1975) por la que los homosexuales varones poseen “cerebro de mujer”.
El núcleo ventromedial del hipotálamo (V.m., Figura 4 A, B) ha sido también implicado en el dimorfismo sexual en los roedores quizá por la influencia hormonal en el desarrollo cerebral neonatal (Matsumoto y Arai, '83). Sin embargo, estos hallazgos no han podido ser corroborados en el cerebro humano. El núcleo de la estría terminal y otros núcleos del área también han sido implicados en el dimorfismo sexual pero sin ser comprobados por otros equipos (Allen y cols., '89 a,b).
La diferenciación sexual del hipotálamo comienza del cuarto al séptimo mes de gestación y continúa hasta los 2 a 4 años postnatales. Si la diferenciación sexual del cerebro tiene lugar en periodos postnatales deberíamos concluir que no solo los factores genéticos, químicos y / u hormonales pueden influir en este fenómeno, sino también los condicionamientos sociales y culturales del entorno del niño/niña.
Otras regiones del sistema nervioso central involucradas en el dimorfismo sexual son: 1) el núcleo espinal del bulbo cavernoso de la médula espinal lumbar (Nordeen y cols., '85) que tendría importancia en la copulación y estaría modulado por los niveles de andrógenos en la época perinatal y en la edad adulta (DeVoogd, '87), y 2) la formación del hipocampo por su importancia en la memoria y procesamiento espacial. Los estudios en humanos por resonancia nuclear magnética están en curso, pero existen datos en roedores que indican que el hipocampo es mayor (11 %) en machos polígamos que en monógamos (en estos últimos no se diferencian de las hembras) (Gibbons, '91). No existe ningún estudio de estos centros del sistema nervioso realizado en individuos homosexuales.
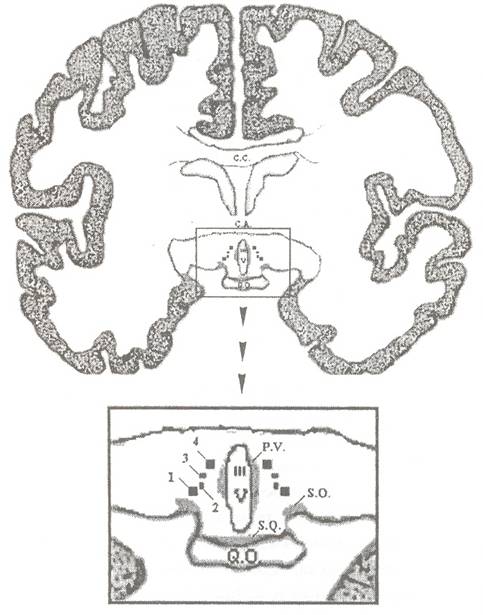
Figura 5
Sección coronal del cerebro humano a nivel del quiasma óptico y la comisura blanca anterior. En el recuadro inferior se observan a mayor aumento los núcleos sexualmente dimórficos del hipotálamo anterior: 1 (INAH1); 2 (INAH2); 3 (INAH3); 4 (TNAH4). Abrev.: III V (tercer ventrículo); C.A. (comisura blanca anterior); C.C. (Cuerpo cayoso); Q.O (quiasma óptico); S.O. (núcleo supraóptico); S.Q. (núcleo supraquiasmático); P.V. (núcleo paraventricular); INAH= intersticial nucleus of the anterior hypothalamus 8núcleo intersticial del hipotálamo anterior)
Comisuras cerebrales
El cerebro, aunque aparentemente constituido de dos partes anatómicas (los dos hemisferios), funciona como un todo, una unidad que controla y adquiere información de todo el cuerpo y del exterior. Las funciones complejas del sistema nervioso central exigen la cooperación de los dos hemisferios, y las lesiones de las áreas de asociación han de ser bilaterales para producir déficits evidentes (Damasio, '90). El hecho de que ambos estén conectados por fibras comisurales aferentes y eferentes aseguran que la información adquirida por un hemisferio sea conocida (y utilizada) por ambos.
El tamaño de las comisuras que comunican un hemisferio cerebral con otro han sido también objeto de estudio de dimorfismo sexual. El interés de conocer el tamaño de las principales comisuras interhemisféricas como el cuerpo calloso (esplenio), la comisura intertalámica o la comisura blanca anterior está en relación a su importancia funcional en la lateralización cerebral (ver apartado C). Así, la comisura blanca anterior (Allen y Gorski, '92) y el esplenio del cuerpo calloso (DeLacoste y Halloway, '82; Hines y Collaer, '93; Holloway y cols., '93) (Figura 4B) parecen ser mayores en mujeres que en hombres. Otros estudios muestran diferencias regionales en el área temporo-parietal que explicarían asimetrías funcionales (Witelson, '91a). Sin embargo, no existe clara evidencia de que estas estructuras puedan ser responsables de la orientación sexual (Bleier y cols., '86; Byne y Parsons, '93).
En varones homosexuales el tamaño de la comisura blanca anterior es menor cuando se compara con heterosexuales (sean hombres o mujeres) (Allen y Gorski, '92). Al igual que el trabajo de LeVay (1991), estos resultados están faltos de crítica y de corroboración.
Existen problemas metodológicos importantes: el número de individuos es particularmente pequeño, y en la mayoría de los estudios los individuos homosexuales padecían SIDA (existiendo la posibilidad que los cambios fueran debidos a consecuencias de la propia enfermedad). Por otra parte, faltan estudios en relación al origen de la orientación sexual de mujeres homosexuales cuya orientación sexual no quedaría demostrada con estos hallazgos.
El limitado conocimiento actual de la neurociencia nos induce a creer que las reacciones y conductas complejas, como lo es la orientación sexual, implican la amígdala, los núcleos septales, la formación hipocampal, la formación reticular, el hipotálamo y amplias áreas de la corteza cerebral. Además, todas estas regiones, que están ricamente interconectadas, cooperan para ejercer una influencia integradora en los efectores periféricos somáticos y autonómicos (Brodal, '92, pp.397). Las evidencias presentadas de variaciones neurobiológicas entre heterosexuales y homosexuales varones, son insuficientes para creer que la orientación sexual pueda estar directa y únicamente en relación al tamaño de una estructura cerebral (Swaab y colso, '92; Swaab y Hofman, '95).
C. FUNCION NEUROPSICOLOGICA
Lateralización de la función cerebral
Una de las teorías mas extendidas sobre la diferenciación sexual (macho-hembra/hombre-mujer) es la lateralización de la función cerebral (McCormick y cols., '90; Halpern y Cass, '94). Cuando un hemisferio es más importante para realizar cierta función, se dice que es dominante para esa función. Por ejemplo, el hemisferio izquierdo es responsable de las funciones del lenguaje, pero no todos los aspectos del lenguaje están localizados en este hemisferio (v.g. la prosodia lo está en el derecho). La lateralización de las funciones de la mano dominante, es menos clara (solo el 30% de los zurdos tiene dominancia del hemisferio derecho para el lenguaje) (Brodal, '92, pp. 423). En general, es aceptado que el hemisferio derecho es superior para las habilidades espaciales, el dibujo, la comprensión de patrones complicados y la expresión de las emociones, y el hemisferio izquierdo lo es para el razonamiento lógico y analítico y la expresión verbal.
¿Es que las mujeres y los hombres poseen diferentes habilidades intelectuales de conocimiento y percepción? Esta cuestión intriga e interesa no solo a los científicos (Begley, '95), pero no existe evidencia absoluta, no se sabe: "Si bien nadie ha observado dichas diferencias, se puede hipotetizar que existen" (Witelson, en Holden, '91). Algunos estudios indican que el hombre en general tiene mejores habilidades visuoespaciales que la mujer, hecho interpretado como rasgo de dimorfismo sexual en el que los varones presentan un mayor grado de lateralización cerebral mientras las mujeres (en general) utilizan ambos hemisferios para realizar cualquier habilidad. Lo que no está demostrado es que una mayor lateralización provoque mayor habilidad visuoespacial en varones y en zurdos (Brodal, '92, pp. 423). Los datos de relación del dimorfismo cerebral con el comportamiento radicarían en que: 1) el tamaño del cuerpo calloso (a nivel del esplenio, Figuras 4 y 5) es mayor en mujeres que varones lo cual determinaría una mayor simetría en las femeninas que les confereriría capacidades diferentes para el habla, la plasticidad y las capacidades perceptuales, y en los varones determinaría mayor lateralización del lenguaje y peor recuperación cuando existen lesiones por accidentes cerebrovasculares (Bleier cols., '86; Halpern y Cass, '94); 2) el lóbulo parietal (habilidad visuoespacial y motricidad) es de mayor localización en los varones; 3) el lóbulo frontal (habilidad verbal) es de mayor localización en mujeres y 4) la circunvolución límbica en situaciones de reposo es más activa en mujeres (Gur y cols., '95).
Las diferencias de comportamiento (Kelley:88) radicarían posiblemente en las variaciones encontradas en las comisuras que comunican ambos hemisferios en primates: el cuerpo calloso (Witelson, '85; Holloway y cols., '93), la masa intermedia intertalámica y la comisura blanca anterior (Allen y Gorski, '92). El cuerpo calloso además decrece más rápidamente con la edad en hombres que en mujeres (Witelson, '91b). Diferencias sexuales en la anatomía del cuerpo calloso reflejan posiblemente diferencias en las estructuras corticales y el comportamiento (Witelson, '85), pero las diferencias sexuales en la función intelectual residen preferentemente en los modelos de capacidad y no en el nivel de inteligencia: los hombres realizan mejor que las mujeres unas habilidades y viceversa (Figura 6) (Kimura, '92; Hedges y Nowell, '95). Los hombres tienen ventaja en las maniobras espaciales (giro en el espacio, recorrido de rutas, razonamiento matemático), en las habilidades motoras y en guiar o interceptar proyectiles. Las mujeres aventajan en velocidad perceptiva, fluidez verbal, en cálculo aritmético, en tareas de precisión y en reparar detalles concretos en el recorrido de una ruta (Kimura, '92). Hampson y Kimura (1992) indican que las hormonas parecen condicionar la resolución de problemas y la agresividad en los varones, influenciando tanto las funciones cognitivas como de conducta (Kelley, '88). Los receptores para testosterona en la amígdala (Breedlove, '83) explicarían el carácter agresivo-combativo de los roedores macho.
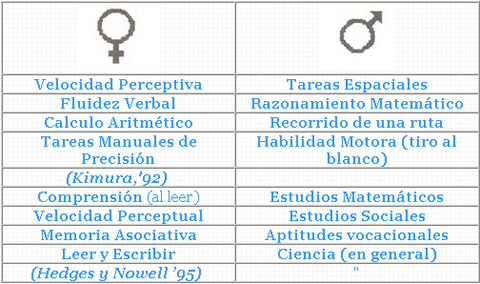
Figura 6
Habilidades intelectuales sexualmente dimórficas en mujeres y hombres
Lateralizacion cerebral en homosexuales
Son múltiples las variables de componente neurobiológico que pueden ser identificadas en relación a la orientación homosexual (McCormick y Witelson, '91) y si bien las diferencias estructurales pueden ser pequeñas, el entorno ambiental y la actuación de las hormonas sobre estructuras superiores como la corteza cerebral puede mediar emociones diferentes, de modo que hombre y mujer tienen diferentes intereses y capacidades ocupacionales.
Geschwind y Galaburda (1985a,b) indican que la testosterona prenatal va a promover el desarrollo de ciertas partes del hemisferio derecho y un más lento crecimiento de las áreas homólogas del hemisferio izquierdo. Se deduce, por ejemplo, que la fluidez verbal estaría disminuida en el hemisferio izquierdo y que sin embargo la habilidad espacial (como el talento musical) serían aspectos de dominancia del hemisferio derecho (Hassler, '93). Sin embargo, aunque la influencia de la testosterona sobre el cerebro en desarrollo pueda contribuir a las bases morfológicas de talentos concretos (fluidez verbal, habilidad espacial, razonamiento matemático) el proceso de aprendizaje a lo largo de la vida debe ser igualmente considerado ya que va afectar el funcionamiento cerebral e incluso la estructura cerebral.
Los dos parámetros que han sido mejor estudiados en homosexuales (varones) han sido la preferencia de mano (Halpern y Cass, '94) y la lateralización del lenguaje. Si es admitido que las mujeres tienden a ser diestras (Hines y Collaer, '93), hay evidencias (aunque rebatidas, Satz y cols., '91) que los homosexuales (hombres y mujeres) tienen preferencia por la utilización de la mano izquierda (McCormick y cols., '90). Y los zurdos tienen el cuerpo calloso mayor (Witelson, '85). El mecanismo hormonal propuesto, y que hace protagonizar al aumento de exposición a los andrógenos durante el desarrollo como explicación del hallazgo en mujeres homosexuales, no es válido para los homosexuales varones. La función neuropsicológica, por si sola, es insuficiente para explicar la causa de la orientación sexual hacia el mismo sexo.
El dimorfismo homosexual neurobiológico estaría en relación primordialmente: 1) con acontecimientos prenatales de tipo neuroendocrino como factor del desarrollo de la orientación sexual y las asimetrías cerebrales funcionales, y 2) con el hecho que los mecanismos asociados a la orientación homosexual y las diferentes características neuropsicológicas entre los sexos (Kimura, '92) correlacionan con elevados niveles de hormonas sexuales prenatales en las mujeres y niveles disminuidos en los hombres. No hay que olvidar, sin embargo, que las mujeres presentan variaciones hormonales periódicas durante su vida fértil y que estas variaciones (significativamente los niveles de progesterona) hacen variar sus respuestas no verbales disminuyendo la velocidad de reacción (Heister y cals., '89). Nadie ha demostrado que los homosexuales varones compartan estas variaciones hormonales periódicas.
El perfil ambiental de un individuo homosexual (varón) incluye generalmente madres superprotectoras, ausencia de modelo varonil, padres ausentes y aislamiento del individuo que va a optar por conductas poco convencionales: estilos de vida e identidades poco conformistas. La mayoría de los estudios que se han realizado se concentran bien en teorías psicosociales, en factores ambientales, o rasgos de personalidad, pero ninguno llega a poder estudiar todas las variables en conjunto. Stoller y Herdt (1985) explican como dos chicos cuyos padres están ausentes, tienen madres protectoras que les inclinan al deporte. Uno de ellos se integra en el equipo de béisbol y desarrolla una orientación heterosexual. El otro no juega al béisbol y desarrolla orientación homosexual. Podríamos pensar que este último poseería una determinación genética o cerebral (por deficiencia hormonal o menor volumen nuclear de INAH3 del hipotálamo) y que por las circunstancias ambientales de perdida de modelo masculino (ausencia del padre) y presencia de madre superprotectora, desarrolla la orientación homosexual. Esta situación nos demuestra lo simplistas que pueden ser este tipo de explicaciones cuando se trata de conocer el origen de una conducta humana del más alto nivel psicológico.
D. FACTORES GENÉTICOS
Los genes van a especificar proteínas, no fenómenos psicológicos ni conductuales. Los humanos son diferentes a la mosca y a otros animales invertebrados, donde han demostrado relación entre genotipo, estructuras cerebrales (lóbulos de las antenas o el corpora pedunculata "cuerpos champiñón" que están involucrados en la olfación para detectar las feromonas sexuales) y orientación sexual (Ferveur y cols., '95). Como sus autores explican, "no hay ninguna indicación de que la organización del cerebro de la mosca sea relevante para un cerebro diferente" (Barinaga, '95). Desconocemos, por el momento, como el cerebro materializa los mecanismos psicológicos complejos pero la interacción de la información genética personalizado junto al ambiente, las conductas aprendidas y el talante personal de cada individuo en su reacción-relación con su ambiente, contribuirían de forma definitiva al aprendizaje social de la determinación-orientación sexual. "Los humanos son organismos creativos que tienen la oportunidad de aprender y tener nuevas experiencias, nuevos ambientes que amplían de este modo los efectos tanto del fenotipo como del genotipo" (Bouchard, '94).
La posibilidad de un factor genético como causa de la homosexualidad esta propuesta desde los hallazgos de Kallmann (1952) que demostraban concordancia del 100% entre gemelos homosexuales monocigotos (MZ) y solo del 12% entre los gemelos homosexuales dicigotos (DZ). Sin embargo, Kallmann rectificó sus hallazgos (1960) indicando que existía artefacto ya que la muestra había sido extraída de una población de enfermos mentales institucionalizados. Sus resultados fueron, no obstante, corroborados (Pillard y Weinnich, '86; Bailey y cols. '91:93), pero otros trabajos son menos optimistas (King y McDonald, '92) . Los estudios de árboles familiares o de gemelos (monocigotos y/o dicigotos) trabajan con la idea de que rasgos genéticos se transmiten entre miembros de una misma familia y que existen bases genéticas que explican la personalidad y los comportamientos complejos del ser humano (Plomin y cols., '94; Thomas, '94). Recientemente, en estudios rigurosos del grupo de Bailey dónde, además de gemelos mono y dicigotos, han incluido hermanos no gemelos y hermanos adoptados, se han establecido diferencias, aunque menores, en homosexuales, tanto en varones (Bailey y Pillard, '91) como en mujeres (Bailey y cols., '93). Los hermanos monociqotos homosexuales compartían toda la Información genética y los dicigotos o los hermanos no gemelos compartían la mitad (50%). Por otra parte, la incidencia de homosexualidad entre hermanos de homosexuales adoptados era mayor (11%) que la de la población general (1-5%). De modo que, aunque exista una tendencia genética de la homosexualidad, las circunstancias ambientales son significativas para la consolidación de la orientación sexual, y viceversa, algunos factores de la personalidad y del temperamento pueden estar influidos por la herencia (genes) y/o los niveles hormonales (Cloninger, '87).
En la misma línea de estudios genéticos, y habiendo observado la existencia de varones homosexuales preferentemente en la línea familiar materna, Hamer y cols. (1993) estudiaron marcadores del DNA en fragmentos del cromosoma X de varones homosexuales encontrando evidencias (discutibles) entre la región subtelomérica Xq28 del brazo largo del cromosoma X (Figura 7). Se llegó a hablar del "Gay Gen", pero se desconoce cual pueda ser dicho gen (la región Xq28 contiene cientos de genes, unos 4 millones de pares de bases). La crítica a este trabajo radica en que si bien los gemelos entre sí concuerdan en el gen implicado, este no es el mismo para todas las parejas de gemelos homosexuales. La mayor parte de los científicos, con los datos de que se dispone en la actualidad, no creen pueda establecerse que un gen determine la orientación sexual per se (Plomin y cols., '94).

Figura 7
Cromosoma 21: en la región subtelomérica del brazo largo, región Xq28, estaría determinada una forma de homosexualidad masculina preferentemente transmitida por vía materna (Hamer y cols., '93).
Conclusión
La homosexualidad queda definida como la orientación sexual hacia miembros del mismo sexo. Aunque los indicios sobre la existencia de una base biológica de la homosexualidad son fragmentarios e incompletos (tanto para hombres como mujeres), en biomedicina y en neurociencia continua siendo un reto conocer y determinar si el proceso de diferenciación sexual conlleva una diferenciación en la organización cerebral.
Aun cuando fuera cierto que el tamaño de ciertas estructuras cerebrales esta en relación con la inclinación sexual de cada sujeto, el conocimiento que poseemos del cerebro es todavía insuficiente para explicar como tales diferencias cuantitativas pueden generar diferencias cualitativas en un fenómeno psicológico tan complejo como la orientación sexual (Swaab y Hofman, '95). El triple control, genético, hormonal y ambiental, del desarrollo del sistema nervioso central proporciona el marco para comprender mejor las facultades del ser humano que supera los instintos transformándolos en tendencias controladas por la voluntad, de modo que ningún factor puede ser determinante de manera independiente. "Las respuestas a estas preguntas pueden no residir tanto en la biología del cerebro sino en las culturas que los cerebros han creado" (Blyne).
Agradecimientos: La autora desea expresar su agradecimiento a la Dra. H. Almirall por sus acertados comentarios.
Correspondencia: M. T. Herrero. Departamento Ciencias Morfológicas y Psicobiología. Facultad medicina, Campus Espinardo. 30071 Murcia. Fax: 34-68-363955. e-mail: mtherrer@fcu.um.es
Referencias
Allen, L.S. y Gorski, RA. (1992) Sexual orientation and the size of the anterior commisure in the human brain. Proc. Natl. Acad. Sci. U.S.A., 89: 7199-7202.
Allen, L.S., Hines, M., Shryne, J.E. y Gorski, RA. (1989a) Two sexually dimorphic cell groups in the human brain. J. Neurosci., 9: 497-506.
Allen, L.S., Hines, M., Shryne, J.E. y Gorski, RA. (1989b) Sex difference in the bed nucleus of the stria terminalis of the human brain. 1. Comp.NeuroI., 302: 697-706.
Anderson, R.H., Fleming, O.E., Rhees, R.W. y Kinghorn, E. (1986) Relationship between sexual behavior, plasma testosterone, and the volume of the sexually dimorphic nucleus of the preoptic area in prenatally stressed and non-stressed rats. Brain Res., 370: 1-10.
Arnold, A.P. Y Gorski, RA. (1984) Gonadal steroid induction of structural sex differences in the CNS. Ann.RevNeurosci., 7: 413-442.
Arendash, G.W. y Gorski, R.A. (1983) Effects of discrete lesions of the sexually dimorphic nucleus of Ihe preoptic area or other medial preoptic regions on the sexual behavior of male rats. Brain Res. Bull., 10: 147-154.
Bailey, J.M. y PilIard, RC. (1991) A genetic study of male sexual orientation. Arch. Gen Psychiatry, 48: 10891096. Bailey, J.M., PilIard, RC., Neale, M.C. y Agyei, Y. (1993) Heritable factors infIuence sexual orientation in women. Arch.Gen Psychiatry, 50: 217-223.
Bakker, J., Van Ophemert, J. y Slob, A.K.(1993) Organization of partner preference and sexual behavior and its nocturnas rhytmicity in male rats. Behav.Neurosci., 107: 1049-1058.
Bancroft, J. (1994) Homosexual orientation. The search for a biological basis. Br. J. Psychiatry, 164: 437-440.
Bardoni, B., Zanaeia, E., Guioli, S., Floridia, G., Workley, K.C., Tonini, G., Ferrante, E., Chiumello, G., McCabe, E.R, Fraccaro M. (1994) A dosage sensitiva locus at chromosome Xp21 is involved in male to female sex reversaI. Nat Genet., 7: 497-501.
Barinaga, M. (1991) Is homosexuality biological? Science (news & comment), 253: 956-957.
Barinaga., B. (1995) Bisexual fruit flies point to brain courtship centers. Science (news & comment), 267: 791792.
Barraclough, C.A. y Haller, E.W. (1970) Positive and negative feedback effects of estrogen on pituitary LH synthesis and release in normal and androgen-sterilized female rats. Endocrinology, 68: 542-551.
Baum, M.J., Carroll, RS., Erskine, M.S. y Tobet, S.A. (1985)
Neuroendocrine response to estrogen and sexualen orientation. Science, 230: 960-961.
Begley, S. (1995) Gray Matters. Newsweek, March, 27: 42-48.
Bleier, R, Houston, L. Y Byne, W. (1986) Can the corpus callosum predict gender, handedness, or cognitive differences? Trends Neurosci., 9: 391-394.
Bouchard, T.J.Jr.(1994) Genes, environment and personality. Science, 264: 1700-1702.
Braak, H. Y Braak, E. (1987) The hypothalamus of Ihe human adult: Chiasmatic region. Anat. Embryol., 176: 315-330.
Breedlove, M. (1983) Regional sex differences in steroid accumulation in the nervous system. Trends Neurosci., 6: 403-406.
Brodal, P. (1992) The Central Nervous System. Structure and function. Oxford University Press. New York.
Burek, M.J., Nordeen, K.w. y Nordeen, E.J. (1995) Estrogen promotes neuron addition to an avian song-control nucleus by regulating post-mitotic events. Dev. Brain Res., 85: 220-224.
Byne, W. y Parsons, B. (1993) Human sexual orientation. The biological theories reappraised. Arch. Gen. Psychiatry, 50: 228-239.
Byne, W.(1994) ¿Una determinación biológica? Investigación y Ciencia, 7: 13-19.
Cloninger,C.R (1987) A systematic method for clinical description and classification of personality variants. Arch. Gen Psych., 44: 573-588.
Commings, D. Y Yahr, P. (1984) AduIt testosterone levels infIuence the morphology of a sexually dimorphic area in the Mongolian gerbil brain. J. Comp. Neurol., 224: 132-140.
Croxson, T.S., Chapman, W.E., Miller, L.K., Levit, C.D., Senie, R y Zumoff, B. (1989) Changes in the hypothalamic-pituitary-gonadal axis in human irnmunodeficiency virus-infected homosexual men. J. Clin. Endocrinol. Metab., 68: 317-321.
Damasio, A.R. (1990) Category-related Recognition defects as a clue to the neural substrates of knowledge. Trends Neurosci., 13: 95-98.
DeJonge, F.H., Louwerse, A.L., Ooms, M.P., Evers, P., Endert, E. y Van de Poll, N.E. (1989) Lesions of Ihe SDNPOA inhibit sexual behaviour of male Wistar rats. Brain Res. Bull., 23: 483-492.
DeLacoste-Utamsing, C. y Holloway, R.L. (1982) Sexual dimorphism in the human corpus callosum. Science, 216: 1431-1432.
DeVoogd, T.J. (1987) Androgens can affect the morphology of mammalian CNS neurons in aduIthood. Trends Neurosci., 10: 341-342.
Dbmer, G. (1985) Sex-specific gonadotrophin secretion, sexual orientation and gender-role behavior. Exp. Clin. Endocrinol., 86: 1-16.
Dómer, G. (1988) Neuroendocrine response to estrogen and brain differentation in heterosexuals, homosexuaIs, and transexuaIs. Arch. Sexual Behav., 17: 57-75.
Dómer, G., Rohde, W., Stahl, E, Krell, L. y Masius, W.G. (1975) A neuroendocrine predisposition for homosexuality in men. Arc. Sex Behav., 4: 1-8.
Dómer, G., Poppe, y., Stahl, F, Kolzsch, J. y Uebelhack, R (1991) Gene- and environment-dependent neuroendocrine etiogenesis of homosexuality and transsexualism. Exp. Clin. Endocrinol., 98: 141-150.
Ehrhardt, AA Y Meyer-Bahlburg (1981) Effects of prenatal sex hormones on gender-related behavior. Science, 211: 1312-1314.
Ehrhardt, A.A., Meyer-Bahlburg, H.EL., Rosen, RL.f Feldman, J.E, Veridiano, N.P., Zimmerman, Y. y McEwen, B.S. (1985) Sexual orientation after prenatal exposure to exogenous estrogen. Are Sex Behav., 14: 57-77.
Ferveur, J.F., stortkuhl, K.F., Stocker, RF. y Greenspan, RJ. (1995) Genetic feminization of brin structures and changes sexual orientation in male Drosphila. Science, 267: 902-905.
Finkelstein, J.5., Neer, R.M., Biller, B.M.K., Crawford, J.D. y Klibanski, A. (1992) Osteopenia in men with a history of delayed puberty. N. Engl. J. Med., 326: 600-604.
Friedman, RC. y Downey, J. (1993) Neurobiology and sexual orientation: current relationships. J. Neuropsychiatry Clin. Neurosci., 5: 131-153.
Geschwind, N. y Galaburda, A.M. (1985a) Cerebral lateralization. Biological mechanisms, associations and pathology. 1. A hypothesis and a program for research. Arch Neurol., 42: 428-459.
Geschwind, N. Y Galaburda, A.M. (1985b) Cerebral lateralization. Biological mechanísms, associations and pathology.II. A hypothesis and a program for research. Arch Neurol., 42: 521-552.
Gibbons, A. (1991) The brain as "sexual organ". Science (news & comments), 253:957-959.
Gladue, B.A., Green, R y Helleman, RE. (1984) Neuroendocrine response to estrogen and sexual orientation. Science, 225: 1496-1499.
Gooren, L. (1986a) The neuroendocrine response of luteinising hormone to estrogen administration in heterosexual, homosexual ans transexual subjects. J. Clin. Endoc. Metab., 63: 583-588.
Gooren, L. (1986b) The neuroendocrine response of luteinising hormone to estrogen administration in humans is not sex specific but dependent on the hormonal environment. J. Clin. Endoc. Metab., 63: 589-593.
Gorski, RA., Gordon, J.H., Shryne, J.E. y Southam, A.M. (1978) Evidence for a morphological sex difference within the medial preoptic area of the rat brain. Brain Res., 148: 333-346.
Greenstein, B.D. (1978) steroid hormone receptors in the brain. Trends Neurosci., 1: 4-6.
Gur, RC., Mozley, L.H., Mozley P.D., Resnick, S.M., Karp, J.S., Alavi, A., Arnold, S.E. y Gur, R.E. (1995) Sex differences in regional cerebral glucose metabolism during a resting state. Science, 267: 528-531.
Halpern, D.F. Y Cass, M. (1994) Laterality, sexual orientation, and immune system functioning: is there a relationship? lnt.J. Neurosci., 77: 167-180.
Hamer, D.H., Hu, S., Magnuson, V'L., Hu, N. y Pattatucci, A.M.L. (1993) A linkage between DNA markers on the X chromosome and male sexual orientation. Science, 261: 321-327.
Hampson, E. y Kimura, D. (1992) Sex differences and hormonal influences on cognitive functions in humans. Behavioral Endocrinology (Becker, J.B, Breedlove, S.M. y Crews, D., eds.). MIT Press, Cambridge, Mass. pp 357. Hassler, M. (1993) Comparing musicians with non-musicians to study human brain function. Conc. Neurosc., 4: 53-75. Hawkins, J.R (1993) The SRY gene. Trends Endocrin. Metab., 4: 328-332.
Hedges,L.V. y Nowell, A. (1995) Sex differences in mental test scores, variability, and numbers of high-scoring individuals. Science, 269: 41-50.
Heimer, y Larsson, (1966)
Heister, G., Landis, T., Ragard, M. y schroeder Heister, P. (1989) Shift of functional cerebral asymmetry during the menstrual cycle. Neuropsych., 27: 871-880.
Hines, M. Y Collaer, M.L. (1993) Gonadal hormones and sexual differentiation in human behavior: new developments from research on endocrino syndromes and studies of brain structure. Ann. Rev. Sex Res., 4: 1-48.
Hofman, M.A. Y Swaab, D.F. (1989) The sexually dimorphic nucleus of the preoptic area in the human brain: a comparativa morphometric study. J. Anat., 164: 55-72.
Hofman, M.A. Y Swaab, D.F. (1991) Sexual dimorphism of the human brain: myth and reality. Exp. Clin. Endocrinol., 98: 161-170.
Hofman, M.A. y Swaab, D.F. (1994) Alterations in circadian rhythmicity of the vasopressin-producing neurons of the human suprachiasmatic nucleus (SCN) with aging. Brain Res., 651: 134-142.
Holden,C.(1991) ls "Gender Gap" narrowing? Science, (news & comment), 253:959-960
Holloway, RL., Anderson, P.J., Defendini, R y Harper, C. (1993) Sexual dimorphism of the human corpus callosum from three independent samples: relative size of the corpus callosum. Am. J. Phys. Antropol., 92: 481-498.
Ito, Y., Fisher, CR, Conte, FA., Grumbach, MM y Simpson, E.R. (1993) Molecular basis of aromatase deficiency in an adult female with sexual infantilism and polycystic ovaries. Proc. Natl. Acad. Sci. USA, 90: 1167311677.
Jacobson, CD., Shryne, J.E., Shapiro, E y Gorski, RA. (1980) ontogeny of the sexually dimorphic nucleus of the preoptic area. J. Coinp. Neurol., 193: 541-548.
Karsch, EJ., Dierschke, D.J.y Knobil, E. (1973) Sexual differentiation of pituitary function: apparent difference between primates and rodents. Science, 179: 484-486.
Kennedy, H. Y Dehay, C (1994) Cortex cerebral: el peso de los genes. Mundo científico, 146 (14): 474-475.
Kallmann, EJ. (1952) Comparative twin study on the genetic aspects of male homosexuality. J. Nerv.Ment.Ois., 115:
Kallman, EJ. (1960) In discussion, Rainer, J.D., Mesnikoff, A., Kolb, L.C y Carr, A. Homosexuality and heterosexuality in identical twins. Psychosom Med., 22: 251-259.
Kelley, D.B. (1988) Sexually dimorphic behaviors. Ann.Rev.
Neurosci., 11: 225-251.
King, M. Y McDonald, E. (1992) Homosexuals who are twins. A study of 46 probands. Br. J. Psych., 160: 407409.
Kimura, D. (1992) Cerebro de varón y cerebro de mujer. Investigación y Ciencia, 11: 77-84.
Koopman, P., Gubbay, J., Vivian, N., Goodfellow, P.N.y Lovel-Badge, R (1991) Male development of chromosomally female mice transgenic for SRY. Nature, 351: 117-121.
Kruijver, EP., de Jonge, EH., van den Broek, W.T., van der Woude, T., Endert, E. y Swaab, D.F (1993) Lesions of the suprachiasmatic nucleus do not disturb sexual orientation of the adult male rat Brain Res., 624: 342-346.
LeVay, S. (1991) A difference in hypothalamic structure between heterosexual and homosexual men. Science, 253: 1034-1037.
LeVay, S. (1993) The sexual brain. MIT Press, Cambridge, Mass.
Lubahn, D.B., Moyer, J.S., Golding, T.S., Couse J.E, Korach, K.S. y Smithies, O. (1993) Alteration of reproductive function but not prenatal sexual development after insertional disruption of the moese estrogen receptor gene. Proc. Natl. Acad Sci. USA, 90: 11162-11166.
Maddox, J. (1991) Is homosexuality hard-wired? Nature (news & views), 353: 13-14.
Matsumoto, A. y Arai, Y. (1983) Sex difference in volume of the ventromedial nucleus of the hypothalamus in the rat. Endocrinol Jpn., 30: 277-280.
McCormick, CM. Y Witelson, S.F (1991) A cognitive profile of homosexual men compared to heterosexual men and women. Psychoneuroendocrinology, 16: 459-473.
McCormick, CM., Witelson, S.F y Kingstone, E. (1990) Left-handedness in homosexual men and women: neuroendocrine implications. Psychoneuroendocrinology, 15(1): 69-76.
McEwen, B.S., Lieberburg, l., Chaptal, C y Krey, L.C (1977) Aromatization: importan for sexual differentiation of the neonatal rat brain. Horm. Behav., 9: 249-263.
Meyer-Bahlburg, H.FL. (1977) Sex hormones and male homosexuality in comparativa perspectiva. Arch. Sex Behav., 6: 297-325.
Meyer-Bahlburg, H.EL. (1984) Psychoendocrine research on sexual orientation: current status and future opinions.Prog. Brain Res., 61: 375-398.
Naftolin, F (1981) Understanding the basis of sex differences. Science, 211: 1263-1263.
Norman, RL. Y Spies, HG. (1986) Cyclic ovarian function in a male macaque: additional evidence for a lack of sexual differentiation in the physiological mechanisms that regulate the cyclic release of gonadotropins in primates. Endocrinology, 118: 2608-2610.
Nordeen, E.J., Nordeen, K.w., Sengelaub, D.R y Arnold, A.P. (1985) Androgens prevent normally occurring cell death in a sexually dimorphic spinal nucleus. Science, 229: 671-673.
Parkhurst, S.M. Y Meneeley, P.M. (1994) Sex determination and dosage compensation: lessons from flies and worms. Science, 264: 924-932.
Parsons, B., Rainbow, T.C., Pfaff, D.W. y McEwen, B.S. (1981) Oestradiol, sexual receptivity and cytosol progestin receptors in the hypothalamus. Nature, 292: 58-59.
Pillard, RC., y Weinnich, J.D. (1986) Evidence of familiar nature of male homosexuality. Arc. Gen. Psych., 43: 808-812.
Plomin, R, Owen, M.J. y McGuffin, P. (1994) The genetics basis of complex behaviors. Science, 264: 17331739.
Purba, J.S., Hofman, M.A., Portegies, P., Troost, D. y Swaab, D.F (1993) Decreased number of oxytocin neurons in the paraventricular nucleus of the human hypothalamus in AIDS. Brain, 116: 795-809.
Raisman, G. Y Field, P.M. (1973) Sexual dimorphism in the neuropil of the preoptic area of the rat and its dependence on neonatal androgen.Brain Res, 54: 1-29.
Riska, B. Y Atchley, W.R (1985) Genetics of growth prediet patterns of brain-size evolution. Science, 229: 668-671.
Rochellys-Diaz, D., Fleming,D.E. y Rhees, RW. (1995) The hormone-sensitive early postnatal periods for sexual differentiation of feminine behavior and luteinizing hormone secretion in male and female rats. Dev. Brain Res., 86: 227-232.
Satz, P., Miller, E.N., Selenes, O., Van Gorp, W., D'Eleia, L.F. y Visscher, B . (1991) Hand preference in homosexual men. Cortex, 27: 295-306.
Smith, P.E., Boyd, E., Franck, G.R., Takahashi, H., Cohen, RM., Specker, B., WIlIíams, T.C., Lubahn, D.B. y Korach, K.S. (1994) Estrogen resistance caused by a mutation in the estrogen-receptor gene in a man. N. Eng1.J. Med., 331: 1056-1061.
Sinclair, A.H., Berta, Ph., Palmer, M.S., Hawkins, J.R, Griffiths, B.L., Smith, M.J., Foster, J.W., Frischauf, A.-M., Lovell-Badge, R y Goodfellow, P.N. (1993) A gene from the human sex-determining region encodes a protein with homology to a conserved DNA-binding motif. Nature 346: 240-244.
Stoller, R.J. Y Herdt, G.H. (1985) Theories of origins of male homosxuality. Arch. Gen. Psych., 42: 399-404.
Swaab, D.F. Y Fliers, E. (1985) A sexually dimorphic nucleus in the human brain. Science, 228: 1112-1115.
Swaab, D.F., Fliers, E. y Partiman, T.S. (1985) The suprachiasmatic nucleus of fue human brain in relation to sex, age and senile dementia. Brain Res., 342: 37-44.
Swaab, D.G., Gooren, L.J. y Hofman, M.A. (1992) Gender and sexual orientation in relation to hypothalamic structures. Horrn. Res., 38 Supp. 2: 51-61.
Swaab, D.F., Slob, A.K., Houtsmuller, E.J., Brand, T. Y Zhou, J.N. (1995) Increased number of vasopressin neurons in the suprachiasmatic nucleus (SCN) of "bisexual" adult male rats following perinatal treatment with the aromatase blocker ATD. Dev. Brain Res., 85: 273-279.
Swaab, D.F. Y Hofman, M.A. (1988) Sexual differentation of the human hypothalamus: ontogeny of the sexually dimorphic nucleus of the preoptic area. Dev. Brain Res., 44: 314-318.
Swaab, D.F. Y Hofman, M.A. (1990) An enlarged suprachiasmatic nucleus in homosexual men. Brain Res., 537: 141-148
Swaab, D.F. Y Hofman, M.A. (1995) Sexual differentiation of the human hypothlamus in relation to gender and sexual orientation. Trends Neurosci., 18: 264-270.
Thomas, J.H. (1994) The rnind of a worm. Science, 264: 1698-1699.
Witelson, S.F. (1985) The brain connection: the corpus callosum is larger in left-handers. Science, 229: 665-668.48.
Witelson, S.F. (1991a) Neural sexual mosaicism: sexual differentation of the human temporo-parietal region for functional asymmetry. Psychoneuroendocrinology, 16: 131153.
Witelson,S.J. (1991b) Sex differences in neuroanatomical changes with aging. N. Engl.J.Med., 325: 211-212.
Zucker, l., Lee, T.M. y Dark, J. (1991) The suprachiasmatic nucleus and annual rhythms of mammals. In: D.C. Klein, RY. Moore and S.M. Reppert (eds.). Suprachiasmatic nucleus: the mindls clock. Oxford University Press, New York. Pp. 246-259.
CUADERNOS DE BIOETICA N° 32
AÑO 1997 |