El descubrimiento de los peligros del alcohol remonta a la más lejana antigüedad; peligros temibles para los padres y para sus descendientes.
¿Conocía ya Aristóteles el síndrome alcohólico-fetal cuando observaba: «Las mujeres casquivanas, o locas, o borrachas, a menudo traen al mundo hijos que se les parecen, lánguidos y tristes»?. A pesar de tales observaciones y de esas advertencias plurimilenarias, ha sido necesario esperar al año 1958 para que el síndrome alcohólico-fetal se convirtiera en una entidad gnosográfica.
Sin embargo, como hacen notar Streissguth et al. en su excelente estudio de 1980 (3), no habían faltado las constataciones. Así aquel informe a la Cámara de los Comunes, de 1884, que observaba que «los hijos de madres alcoholizadas tienen un aspecto imperfecto, de hambre, de sufrimiento», o la nota de Sullivan (1899) que «la mortandad infantil y la mortandad después del parto es dos veces más elevada en la descendencia de madres alcoholizadas que en las otras detenidas en la prisión de Liverpool». Pero hay que reconocer que Lemoine, Harousseau, Borteyru y Menguet tuvieron en 1958 el merito indiscutible de describir el síndrome no solo en el recién nacido y en el niño, sino también en el adolescente y en el joven adulto, seguidos durante muchos años.
Treinta años después, su primera descripción no tiene una imperfección: júzguese.

1. Estudio clínico (texto de Lemoine et al., 1958)
Cuatro puntos nos han sorprendido particularmente en estos niños:
— un aspecto muy particular;
— una hipotrofia estatura-peso considerable;
— una gran frecuencia de malformaciones;
— perturbaciones psicomotoras.
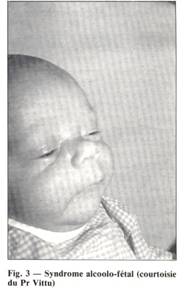
A) El aspecto facial
Es el elemento que primero ha llamado nuestra atención. Estos niños se parecen todos (hasta el punto de que frecuentemente nos sucede que afirmamos el etilismo materno a la simple vista de un niño y que, después, la indagación social nos ha confirmado siempre los hechos).
1. El perfil, sobre todo, es característico:
— frente baja, abombada, en contraste con los arcos ciliares allanados;
— base nasal hundida, como formando una ensilladura, nariz corta como trompeta;
— labio superior encogido, lo que le da un perfil convexo (serial particularmente constante);
— mentón inexistente por un importante retrognatismo;
— orejas mal dispuestas, deformadas, con un borde superior horizontal.
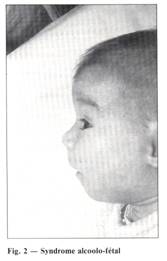
2. De frente:
— frente estrecha;
— boca alargada;
— orejas prominentes.
Este aspecto facial es muy típico durante los dos primeros años. Con la edad, los rasgos se modifican, pero el niño conserva cabeza pequeña, arrugada, ininteligente, en la que persisten en particular el retrognatismo, la base nasal hundida con nariz en trompeta, las orejas prominentes. Para describir completamente el síndrome habría que repetir toda la publicación de Lemoine et al., con la hipotrofia estatura-peso, las malformaciones asociadas, sobre todo cardiacas, y las anomalías psicomotoras. Estos niños muy hiperactivos tienen un desarrollo retardado «Los mayores son agitados, turbulentos, pendencieros, pero inestables e incapaces de una actividad continuada. El coeficiente de inteligencia es, más o menos, 70». Las múltiples publicaciones posteriores no han hecho más que completar ese cuadro dismórfico y neuropsiquiátrico, confirmando su realidad en todas las poblaciones y en todas las razas estudiadas. Así Rostand et al. (1990) observan en Francia una correlación entre la gravedad de los síndromes dismórficos y la cantidad de alcohol ingerido por la madre durante el embarazo, mientras Walpole et al. (1990) llegan a la conclusión, en Australia, de la inocuidad de dosis moderadas; las dos encuestas señalan, además, una correlación con el tabaquismo.
En el animal, todas las experiencias muestran que la alcoholización de la hembra preñada, incluso en dosis moderadas, aun bajo forma de una embriaguez semanal en el macaco (Clarren 1990) comporta riesgos para el feto.
El importante estudio de Streissguth et al., 1991, confirma las observaciones de Lemoine et al.
El retraso en el desarrollo, el coeficiente de inteligencia 70, la inestabilidad persistente, las lentitudes de aprendizaje, las deficiencias de atención y de control de sí mismo y la dificultad de tener en cuenta las reacciones de los demás, evocan a veces un autismo incipiente o una psicosis regresiva moderada. Y el reciente estudio de Vittu, Delcrois, Feldman-Desrousseaux y Bourlet (1991) perfila aun más el cuadro clínico.
Queda por comprender la patogenia propiamente dicha; la toxicidad del alcohol ya no precisa demostración, pero que relaciones pueden existir entre esta molécula muy simple y la tríada sintomática que comprende:
— la dismorfia facial;
— la hipertrofia y las malformaciones asociadas;
— las anomalías persistentes de la inteligencia y del comportamiento.
2. Patogenía comparada
Resumiendo gran numero de datos experimentales, Seyoum y Persaud (1991) observan la acción protectora del zinc (Favier et al., 1987) y de la metionina.
El alcohol deshidrogenasis que transforma el etanol en acetaldehido, es una enzima con zinc, que regula los niveles sanguíneos de alcohol (Chernoff, 1980).
El zinc sanguíneo esta en menor cantidad en los niños atacados (Assidi y Ziai, 1985) y en sus madres (Flynn et al., 1981).
En el ratón (Miller et al., 1983) y en la rata (Ruth y Goldsmith, 1981) la carencia de zinc aumenta los daños del alcohol, mientras que la presencia de zinc protege a los pequeños (Tanaka et al., 1982) (Keppen et al., 1985).
En cuanto a la metionina, se sabe que la carencia es clásica en el alcoholismo crónico, pero administrada a ratas alcoholizadas disminuye el nivel de aldehído en circulación (Tabakoff et al., 1989).
Como el acetaldehído (Barak y Beckenhauer, 1988) inhibe en un 74% la metioninasintasis y forma aductos con el N5 metil-tetrahidrofolato (que permite la remetilación de la homocisteína en metionina mediante la B12) es necesario ver una relación eventual entre el acetaldehido y el metabolismo de los monocarbonos (fig. 1). Pero antes de discutir los posibles mecanismos bioquímicos, merece atención una confrontación anatómico-química con los síndromes dismórficos próximos.
Además de la deficiencia mental con microcefalia, la intoxicación alcohólica del feto comporta efectivamente en el hombre (y también en el ratón, como han mostrado Sulik et al., 1981) una dismorfia facial típica: hendiduras palpebrales estrechas, nariz corta con realce de los orificios nasales, ausencia de los apoyos del philtrum del labio superior y micro-retrognatismo.
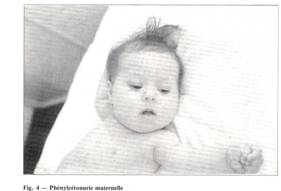
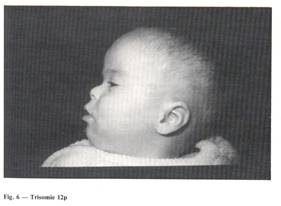
Ahora bien, se conocen varias debilidades mentales que comportan dismorfías muy próximas:
— la trisomía 21;
— la trisomía 12p;
— la hipotiroides congénita;
— la intoxicación del feto por una fenilcetonuría materna.
Como se ve en la lamina 2, las dismorfias son parecidas y se reseñan malformaciones asociadas, sobre todo cardiacas, con frecuencias comparables.
Ahora bien, estos cuatro síndromes están directamente relacionados con el metabolismo de los monocarbonos.
En la trisomía 21, la hipersensibilidad al metotrexato (Peeters et al., 1985; Lejeune et al., 1986) va acompañada por un déficit relativo de serina con exceso de cisteína (Lejeune et al., comunicación personal), de donde proviene un desequilibrio grave del metabolismo de los monocarbonos (fig. 1).
Por su parte, la hipotiroidía (para referencias, ver Lejeune 1990) rebaja la llegada de radicales formil mediante la formil-sintasis y acelera su eliminación mediante la formil-deshidrogenasis, de donde un notable déficit de monocarbonos oxidados (fig. 1).
Sobre el cromosoma 12 se localiza el gene de una de las mayores enzimas de los monocarbonos, la serina Hidroximetil transferasis (en 12ql3) y el brazo corto del 12 contiene varios genes que regulan la glicolisis.
En fin, el síndrome dismórfico de los niños nacidos de una madre fenilcetonúrica (por lo tanto, a priori heterozigotos normales), es prácticamente idéntico al síndrome alcohólico-fetal, como ya lo habían observado Lipson et al., 1981. Ahora bien, uno de los metabolitos de la fenilalanina seria tal vez capaz de bloquear la formil-transferasis, siendo el candidato más plausible no el fenil-piruvato, sino más bien, después de la decarboxilación, el fenilacetaldehido próximo al fenilacetato.
Hipótesis heurística
Para dar cuenta de estas convergencias fenotípicas, la hipótesis más simple seria que los cuatro síndromes, aparentemente muy heterogéneos, lleven consigo un disturbio metabólico particular.
Por ejemplo, el etanol, CH3-CH2OH se parece mucho al radical hidroximetil CHOH, transferido por la serina hidroximetiltransferasis. Una inhibición por competición sería muy plausible, tanto más que el alcohol metílico CH3OH (que podría adaptarse aún más exactamente al lugar característico del radicalCHOH) es aun mucho más toxico que el etanol.
Ahora bien, sucede que la serinahidroximetiltransferasis puede también combinar el acetaldehído y la glicina para sintetizar la treonina, acido amino indispensable, cuyo metabolismo podría ser perturbado en ciertas psicosis (Lejeune et al., comunicación personal).

El catabolismo de la treonina conduce al metilglioxal, homologo inferior del dioxavalerato (o DOVA de la fig.l), uno de los más importantes donantes de radical formil en la formilsintasis. Si el metilglioxal fuera también un donante de monocarbonos (lo que está por demostrar), resultaría acetaldehido para transformar en acetato mediante la aldehído-deshidrogenasis.
Por último, si el alcohol inhibe parcialmente la serina-hidroximetiltransferasis (embriaguez) y el acetaldehído inhibe la formiltransferasis (toxicidad neurológica), entonces el «aire de familia» observado entre las dismorfias que acabamos de comparar, procedería de un déficit común de monocarbonos oxidados: ya sea por bloqueo de la formiltransferasis por el acetaldehído (síndrome alcohol-fetal), o por el fenilacetal-dehido (hijo de madre fenilcetonúrica); ya sea por desarreglo de la formilsintasis y de la formildeshidrogenasis (hipotiroidea); ya por desviación metabólica resultante de otro efecto de dosificación génica (trisomía 21, trisomía 12p). Quedaría por comprender por qué hijos genéticamente indemnes, pero intoxicados en el útero por los derivados del alcohol o de la fenilalanina, conservan un déficit de desarrollo físico y motor, incluso por mucho tiempo después de la supresión del tóxico.
Este hecho está comprobado experimentalmente en el macaco (Clarren 1991) y la rata alcoholizada en el útero (y sometida después a un régimen normal) sufre en el estado adulto un déficit persistente de las hisozimás del alcohol deshidrogenasis (Paredes, 1990). Entonces es forzoso suponer un mecanismo epigenético que modificaría duraderamente la regulación génica de las enzimas cuyo equilibrio ha sido modificado por la alcoholización. Una eventual metilación (o desmetilación) de ciertas secuencias reguladoras del genoma podría explicar esta aparente irreversibilidad de un «carácter adquirido».
Si se (tratara de una «huella» patológica, quedaría por considerar (cf. Lejeune 1991, para discusión) si el reequilibrio (por administración de precursores, de transportadores o de productos finales del metabolismo de los monocarbonos) sería beneficioso o incluso permitiría «reprogramar» las secuencias reguladas anormalmente.
No se nos oculta que estas reflexiones son puramente heurísticas y que una investigación experimental sería indispensable para confirmar su validez. En todo caso, no nos ha parecido inoportuno someterlas a los especialistas aquí presentes, ya que es tan grande la necesidad de ayudar a los niños tan injustamente castigados.
Prof. Jerome Lejeune
Académico
Bibliografía
1. Assadi F.K., Ziai M. Zinc deficiency in infants with foetal alcohol syndrome. Pediatric-Research 1985, 19, 167
2. Barak A.J., Beckenhauer HS., The influence of ethanol on hepatic transmethylation. Alcohol and Aloholism. 1988, 23,73
3. Chernoff GF. The fetal alcohol syndrome in mice: maternal variables. Teratology 1980, 22, 71-75
4. Clarres S.K. Fetal alcohol effects in a non-human primate model. Dose-response for behavioral and structural brain alteration, in: Alcohol and fetal development. Oct.4-5 1990. Valencia Spain pp.23-24.
5. Favier M., Favier A., Robert E. et Guignkr M. La carence en zinc chez la mère peut-ètre responsble de I'apparition de spina bifida aperta chez le foetus. Rev.Int. Pediat. 1987, 174, 34-40
6. Flvnn A., Martier SS., Sokol, R.J., Miller S.I., Golden N.L., Delvillno B.C. Zinc status of pregnant alcoholic women: a determinant of fetal outcome. Lancet 1981,572-574
7. Jones K.L., Smith D.W., Ulleland C.N. Pattern of malformations in offspring of chronic alcoholic women. Lancet i, 1973, 1267-1271
8. Kepplen L.D., Pysher T., Rennert O.M. Zinc deficiency act as a coteratogen with alcohol in fetal alcohol syndrome. Pediatr. Res. 1985, 19, 944-947
9. Lejeune J, Pathogenesis of mental deficiency in trisomic 21. Am J Med Genet. 1990, 37. 20-30
10. Lejeune J. Pathogénie de la debilité de I'intelligence dans la trisomie 21. Ann Génét. 1991, 34, 55-64
11. Lejeune J., Rethore M.O., De Blois M.C., Maunoury Burolla C., Mir M.,Nlcolle L., Borowy F., Borgi E., Recan D. Métabolisme des monocarbones et trisomie 21: sensibilité au méthotrexate. A.Génét.1986, 29, 16-19
12. Lemoine P., Harrousseau H., Borteyru J. et Menuet J. Les enfants de parents alcooliques. Anomalies observées. Ouest Médical 1968, 25, 477
13. Lipson A.M., Yu J.S., O'halloran M.T. et Williams R. Alcohol and phenylketonuria. Lancet i. 1981, 717-718
14. Miller S.J., Del Villano B.C., Flynn A., Krumhansl M. Interaction of alcohol and zinc in fetal sysmorphogenesis. Pharmacol. Biochem. Behav. 1983, 18, 311-315
15. Pares X. Effect of pre and post natal ethanol intake in the development of alcohol dehydrogenase isoenzymes, in: Alcohol and fetal development, oct. 4-5 1990 Valencia Spain pp. 27-28
16. Peeters M., Poon A., Zipursky A et Olive D. Down's syndrome and leukemia: unusual clinical presentation; unexpected methotrexate sinsitivity. Eur. J. Pediatr, 1985, 144, 115
17. Ruth R.E. et Goldsmith S.K. Interaction between zinc deprivation and acute ethanol intoxication during pregnancy in rats. J. Nutr. 1981, 111, 2034-2038
18. Seyoum G.G. el Persaud T.V.N. Can Methionine and Zinc prevent the embryopathic effects of Alcohol. Medical Hypotheses 1991, 34, 153-156
19. Steissguth A.P., Landesman-Dwyeh S., Martin J.C. et Smith D.W. Teratogenic effects of alcohol in humans and laboratory animals. Science 1980, 209, 353-361
20. Streissguth A.P., Aase J.M., Clarren S.K., Randels S.P., Landuer. A., Smith D.F. Fetal alcohol syndrome in adolescents and adults. JAMA 1991, 265, 1961-1967
21. Sulik K.K., Johnston M.C. Webb M.A. Fetal alcohol syndrome: embryogenesis in a mouse model. Science 1981, 214, 936-938
22. Tabakoff B., Eriksson Cjp., Von Wart-Burg J.P. Methionine lowers circulating levels of acetaldehide after ethanol ingestion. Alcoholism: Clin. Exp. Res. 1989, 13, 164
23. Tanaka H., Nakazawa K., Suzuki N, Ariman. Prevention possibility for brain dysfunction in rat with fetal alcohol syndrome-leso zinc status and hypoglycemia. Brain Dev. 1982, 4, 429-438
24. Vittu G. Le Nouveau-né de mère alcoolique. Revue du Pédiatre. 1991, 2, 42-44 |